溶酶体中存在多种负责降解多肽或蛋白质的蛋白水解酶。为确保它们在特定部位与环境发挥催化作用、避免“滥杀无辜”,蛋白水解酶通常以酶原的形式在囊泡内大量储存。在传统认识中,酶原是不具有催化活性的前体蛋白。然而,酶原在功能上真的只是“沉默的大多数”吗?
段树民院士团队近期研究发现,溶酶体蛋白水解酶cathepsin D的酶原蛋白具有pH和构象双重依赖的非经典磷酸酶活性。
作为溶酶体中主要的蛋白水解酶,cathepsin D参与调控蛋白降解相关的多种生理和病理过程。cathepsin D蛋白在一些肿瘤组织中持续高表达,而这种高丰度表达通常提示预后不良。尽管cathepsin D的成熟及催化过程均依赖酸性pH 环境,近年研究发现,脱离酸性pH环境的cathepsin D、未成熟cathepsin D,以及缺失蛋白酶活性的cathepsin D突变蛋白,都与野生型cathepsin D蛋白类似,同样具有促进细胞增殖和迁移的功能,提示cathepsin D可能具有不依赖酸性pH环境的非蛋白水解酶活性。
段树民院士团队前期工作发现,未成熟cathepsin D可以被晚期内吞体释放至胞浆,参与调控微丝骨架重组、维持细胞快速迁移(2020年12月发表于Science Advances杂志,doi: 10.1126/sciadv.aba5783)。为进一步解析cathepsin D 在中性pH环境中的功能,研究团队利用纯化重组蛋白进行体外酶活性分析,同时构建果蝇和小鼠研究模型,对cathepsin D 的非蛋白水解功能进行深入研究。令人意外的是,中性pH环境中未成熟的cathepsin D具有非经典的磷酸酶活性。在细胞微丝骨架发生迅速重组时,未成熟cathepsin D直接去磷酸化并激活丝切蛋白cofilin、调控细胞微丝骨架组装。当cathepsin D的磷酸酶活性缺失后,细胞胞质分裂停滞,产生畸形的多核巨细胞,进而抑制细胞增殖。这些研究结果表明,cathepsin D在成熟前后分别具有中性pH依赖的磷酸酶活性和酸性pH依赖的蛋白酶活性,尚未成熟的cathepsin D可以通过磷酸酶活性调控微丝骨架重组和细胞分裂增殖。
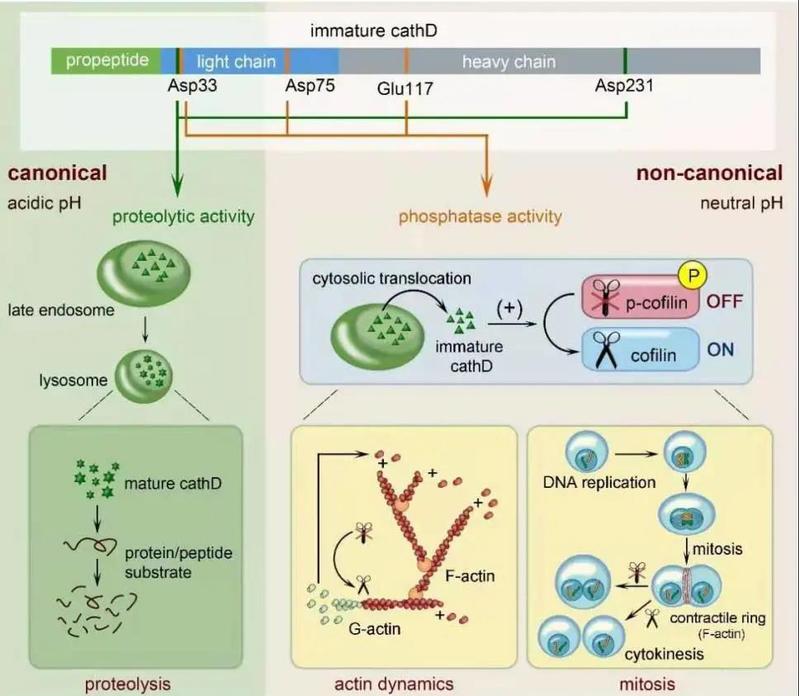
该工作突破了酶原蛋白不具有酶活性的传统认识,同时对相关肿瘤的研究与治疗提供了崭新的思路。本研究结果于2021年1月29日在线发表于Cell Research杂志(https://doi.org/10.1038/s41422-020-00454-w)
该工作由浙江大学医学院段树民院士指导,上海科技大学何淑君、浙江大学医学院王晓东、刘怿君为本文共同通讯作者,刘怿君和段树民院士团队博士后张婷为并列第一作者。该研究得到中科院遗传发育所张永清研究员、清华大学俞立教授、中科院生物物理所冯巍研究员、北京大学唐淳教授的支持和帮助,受到科技部重点研发计划、国家基金委、浙江省重点研发计划、广东省科技计划项目等项目资助。
来源:浙江大学脑科学与脑医学学院公众号




