2020年12月11日,国际学术期刊Science Advances发表浙江大学医学院郭江涛课题组的研究论文Structures and an activation mechanism of human potassium-chloride cotransporters,报道人源钾氯共转运蛋白KCC2、KCC3和KCC4的2.9-3.6 Å高分辨率冷冻电镜结构,并揭示了KCC家族保守的N末端肽段自抑制现象,为靶向KCC2的抗癫痫药物开发提供了全新的思路。这是该课题组一年多来在癫痫相关跨膜转运蛋白领域发表的第3篇高水平研究论文。
遗传性癫痫病与离子跨膜转运
癫痫是一大类神经系统疾病,以脑神经元异常放电引起反复痫性发作为特征,是神经系统常见疾病之一。全世界癫痫病发病率约为1%,即全球约有5千万人患有各种癫痫病。癫痫病的主要发病机理目前尚不清楚,脑部的外伤、中风、脑瘤、遗传缺陷等都有可能引发癫痫病。大量研究显示,在没有明确的外部获得性因素的癫痫病例中,遗传因素发挥了主要作用,大约45%的癫痫为遗传性癫痫或遗传因素相关性癫痫。离子跨膜转运对于维持神经元的离子稳态和膜电位的稳定性至关重要。因此,各种离子通道如钠通道、钾通道和离子转运蛋白如钾氯共转运蛋白、氯离子转运蛋白等既是诱发遗传性癫痫的突变基因,也是治疗癫痫的重要药物靶点。
浙江大学医学院郭江涛课题组自2018年1月份组建以来,以癫痫相关跨膜转运蛋白为研究对象,采用单颗粒冷冻电镜技术、离子转运活性实验、电生理、分子动力学模拟等方法,系统地研究了钾氯共转运蛋白KCC和钾离子通道KCNQ2的结构和调控机理,取得了一系列原创性的研究成果,为后期研发靶向KCC和KCNQ2的抗癫痫药打下了坚实的基础。
钾氯共转运蛋白KCC的结构和机理
钾氯共转运蛋白KCC2介导钾离子和氯离子的外排,在维持突触后抑制性神经元内的氯离子稳态方面发挥着关键作用。KCC2的突变会导致抑制性神经元内的氯离子浓度升高,膜电位易于去极化,引发持续性动作电位,从而导致癫痫。因此,开发KCC2的激动剂成为治疗癫痫的一个重要研究方向。但是,长期以来,人们对KCC的结构和分子机理认识非常有限,这极大限制了KCC2激动剂的开发。
2019年10月25日,郭江涛课题组在国际顶级杂志Science发表文章Cryo-EM structures of the human cation-chloride cotransporter KCC1,首次报道人源钾氯共转运蛋白KCC1的2.9埃高分辨率冷冻电镜结构。该研究解析了包含胞外区和跨膜区的KCC1二体结构,明确了1个钾离子和2个氯离子的结合位点,并基于结构提出一个钾氯共转运的模型。这是国际上首次报道高分辨率KCC的结构。该研究对于离子结合位点的确认,特别是第2个氯离子的结构和功能的阐述,更新了人们对KCC的离子转运机理的认识。
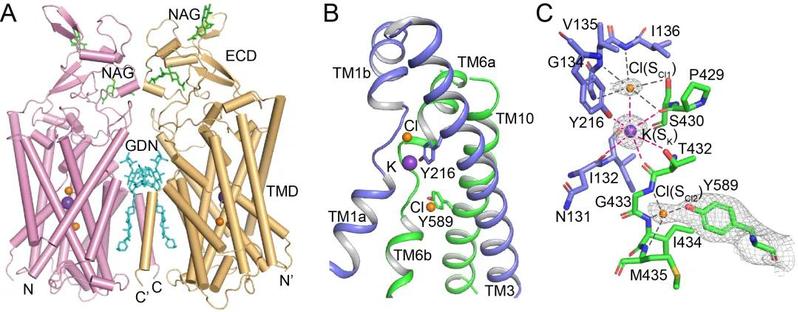
图1.KCC1的结构。A,KCC1二体的卡通模式图。B-C,钾离子和氯离子在KCC1的结合位点。

图2.KCC2的结构。A,KCC2二体的密度图。B,N末端肽段(黄色)结合在内向开放口袋,并与胞内结构域(CTD)作用。C,N末端肽段阻断了底物结合和构象变化。
在此基础上,郭江涛课题组继续深入研究KCC家族的结构和机理。他们日前发表在Science Advances的研究论文报道了人源钾氯共转运蛋白家族另外3个成员(KCC2,3,4)的全长结构。他们发现,KCC2、KCC3和KCC4处于自抑制状态:N末端肽段结合在底物离子结合口袋,从而抑制了底物离子的结合和转运过程中的构象变化。KCC属于氨基酸-多胺-有机阳离子转运蛋白超家族(amino acid–polyamine-organocation (APC) transporter superfamily)。这是首次发现APC超家族中存在N末端肽段自抑制现象。这一发现为靶向KCC2的抗癫痫药物开发提供了全新的思路。在后续研究中,有望基于KCC2的结构设计别构调控分子,减弱N末端抑制性肽段的结合,同时不影响KCC2的转运过程,达到激活KCC2的目的。
钾通道KCNQ2的结构和药物激活机理
电压门控钾离子通道KCNQ家族在维持细胞兴奋性和离子平衡等生理过程中发挥重要作用。KCNQ2和KCNQ3是形成神经元M电流的主要分子基础。KCNQ2基因突变会引发良性家族性新生儿惊厥症和癫痫性脑病的发生。此外,神经元过度兴奋也会引发其他疾病如疼痛、帕金森病、局部缺血、精神分裂症等;调节KCNQ2是治疗这些疾病的一种潜在策略。因此,KCNQ2是一个与多种神经疾病相关的重要药物靶点。
许多小分子药物通过激活KCNQ2来达到治疗效果。瑞替加滨(Retigabine,RTG)是第一个靶向KCNQ2通道治疗癫痫疾病的激动剂,2011年被批准使用,主要用于辅助治疗成人难治性癫痫部分性发作。然而,瑞替加滨由于选择性较差会对患者造成一定的副作用,会造成患者眼睛和皮肤的色素沉积。另一种化合物ICA-27243,与RTG具有不同的作用位点,可选择性激活KCNQ2/3通道,并在癫痫模型小鼠中表现出抗惊厥活性。
为了揭示KCNQ2的配体激活机制,促进抗癫痫药的开发,郭江涛课题组系统地研究了KCNQ2的配体激活机理,于2020年9月3日在Cell Research上发表研究论文Molecular basis for ligand activation of the human KCNQ2 channel,报道人源KCNQ2及其与抗癫痫药瑞替加滨和激动剂ztz240 (一种ICA-27243结构类似物)的结构。该研究解析了KCNQ2-CaM复合物的四聚体结构,从结构上明确了抗癫痫药瑞替加滨和激动剂ztz240的不同结合位点,并揭示两种配体激活KCNQ2的不同分子机制。在目前抗癫痫药物存在副作用的情况下,该研究将加大促进抗癫痫药物的开发和优化。
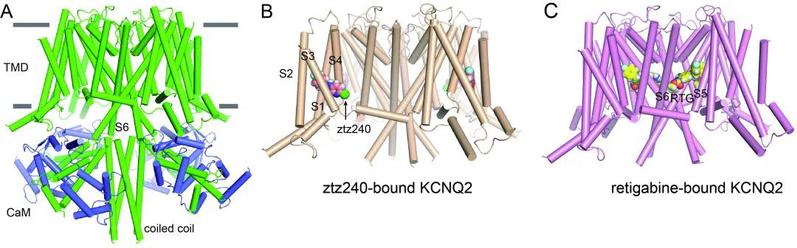
图3.KCNQ2的结构。A,KCNQ2-CaM复合物的结构。B,激动剂ztz240结合在KCNQ2的电压感受器结构域。C,抗癫痫药瑞替加滨结合在KCNQ2的孔道结构域。
展望
癫痫是一类复杂的神经系统疾病。近年来,得益于分子遗传学、电生理、光遗传学、单颗粒冷冻电镜等技术的突破和应用,人们对其分子机理有了进一步的了解。郭江涛实验室聚焦癫痫病,联合多个不同研究方向的实验室,开拓跨膜转运蛋白结构生物学的基础研究。针对KCC和KCNQ2的结构研究,不仅阐明了这两类蛋白的功能基础和突变致病机理,而且为药物研发提供了坚实的基础。未来,以跨膜转运蛋白结构为依据,借助人工智能开展抗癫痫药的精准设计和筛选,将极大加大新型抗癫痫药的开发,实现癫痫病的精准治疗。
参考文献:
1.Xie Y, Chang S, Zhao C, Wang F, Liu S, Wang J, Delpire E*, Ye S*, Guo J*. Structures and an activation mechanism of human potassium-chloride cotransporters. Sci Adv 6, eabc5883 (2020).
2.Liu S#, Chang S#, Han B#, Xu L, Zhang M, Zhao C, Yang W, Wang F, Li J*, Delpire E*, Ye S*, Bai X*, Guo J*. Cryo-EM structures of the human cation-chloride cotransporter KCC1. Science 366, 505–508 (2019).
3.Li X#, Zhang Q#, Guo P#, Fu J, Mei L, Lv D, Wang J, Lai D, Ye S, Yang H*, Guo J*. Molecular basis for ligand activation of the human KCNQ2 channel. Cell Res doi.org/10.1038/s41422-020-00410-8 (2020).
来源:浙江大学医学院




