12月7日,浙江大学医学院附属第一医院卫生部多器官联合移植研究重点实验室王杭祥课题组联合浙江大学药学院高建青课题组在Nano Today在线发表了题为“Quantitative self-assembly of photoactivatable small molecular prodrug cocktails for safe and potent cancer chemo-photodynamic therapy”的研究论文。

该团队报道了一种光可激活的卡巴他赛前药(LTK-CTX)和二氢卟吩e6前药(L-Ce6)自组装形成的无载体纳米药物(PSPC NAs)。该体系在红外光激活下可有效抑制黑色素瘤移植瘤和人源黑色素瘤组织移植瘤(PDX)的生长,且显著扩大了卡巴他赛药物的治疗窗,为临床恶性肿瘤的综合治疗提供了新思路。
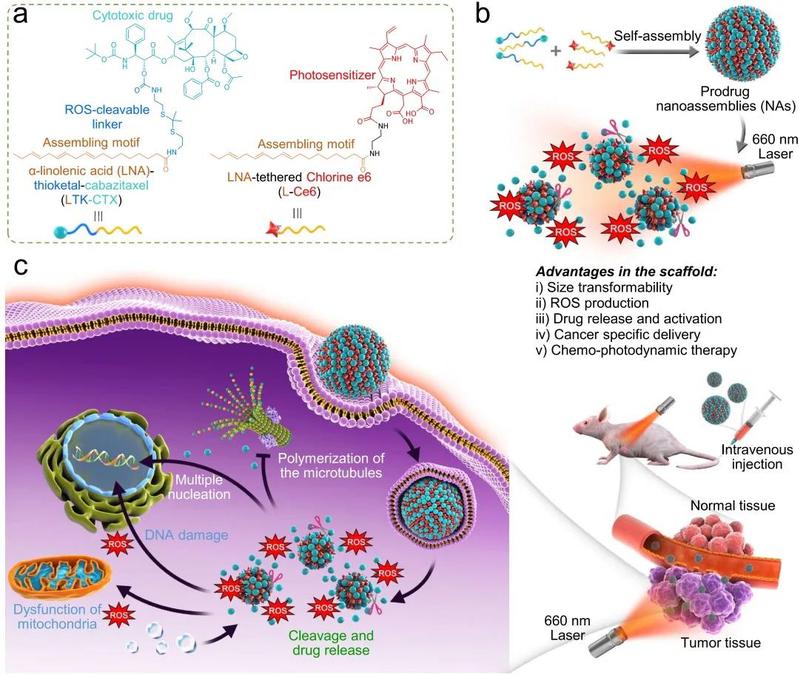
图1. 红外光可激活的小分子前药用于定量自组装纳米药物,并在黑色素肿瘤的化疗/光动力治疗中显示较好的疗效和安全性。(a)不饱和脂肪酸化的卡巴他赛前药(LTK-CTX)和二氢卟吩e6前药(L-Ce6)。(b)两种前药可共组装形成鸡尾酒混合型药物递送系统 (PSPC NAs),Ce6在红外光激活后产生ROS,可发挥旁观者效应,有效触发级联反应以降解ROS敏感键并释放出活性化疗药物。(c)被肿瘤细胞有效摄取的PSPC NAs发挥化疗/光动力协同作用,产生抗肿瘤效应。
超分子自组装体是利用单个分子构件之间的非共价相互作用形成的纳米尺寸的组件。其中利用小分子前药的自组装体系,与传统的基于聚合物的药物递送相比,具有高载药量,可表征和明确的药物化学结构,同时避免高分子材料引入的潜在毒性。王杭祥课题组前期首创将天然来源的多不饱和脂肪酸(Polyunsaturated Fatty Acid, PUFA)与水不溶解的药物共价偶联制备小分子前药,并发现药物经偶联PUFA后具备了在水溶液中自组装的能力。课题组命名该技术为药物的PUFAylation。使用该PUFAylation技术,不仅实现了疏水性药物在不使用任何表面活性剂的情况下实现静脉可注射,同时可增强前药分子与脂质细胞膜的亲和力,促进了肿瘤细胞对药物的摄取。此外,自组装型的纳米给药系统可极大提高药物的体内循环时间,通过药物与PUFA之间合理的连接键的设计,可实现药物在肿瘤微环境的特异性释放,从而降低系统给药的毒副作用。
在前期研究基础上,本研究首次实现了基于PUFAylation技术的光可激活小分子前药的定量共组装。两种PUFAylated前药均能在较宽的摩尔比范围内共组装形成稳定的纳米组装体。在近红外(NIR)光激活下,L-Ce6产生的ROS不仅能促进DNA损伤,线粒体膜电位下降,还可通过旁观者效应促使ROS敏感的thioketal键的断裂释放活性卡巴他赛抑制微管解聚,达到化疗/光动力协同治疗肿瘤的作用。
体内药效实验证明,相较于临床上卡巴他赛静脉注射的给药剂型(添加表面活性剂吐温80,并用13%的乙醇水溶液稀释),基于PUFAylation技术构建的前药共组装PSPC NAs体显著增加了药物在肿瘤组织中的蓄积。同时在A375移植瘤和人黑色素瘤来源的移植瘤PDX模型中,PSPC NAs显著抑制了黑色素瘤的生长,并扩大了化疗药物的治疗窗。此外,纳米制剂实现了无表面活性剂和无载体的给药策略,进一步降低了药物的系统毒性,为临床的恶性肿瘤的化疗/光动力治疗提供了新的思路。
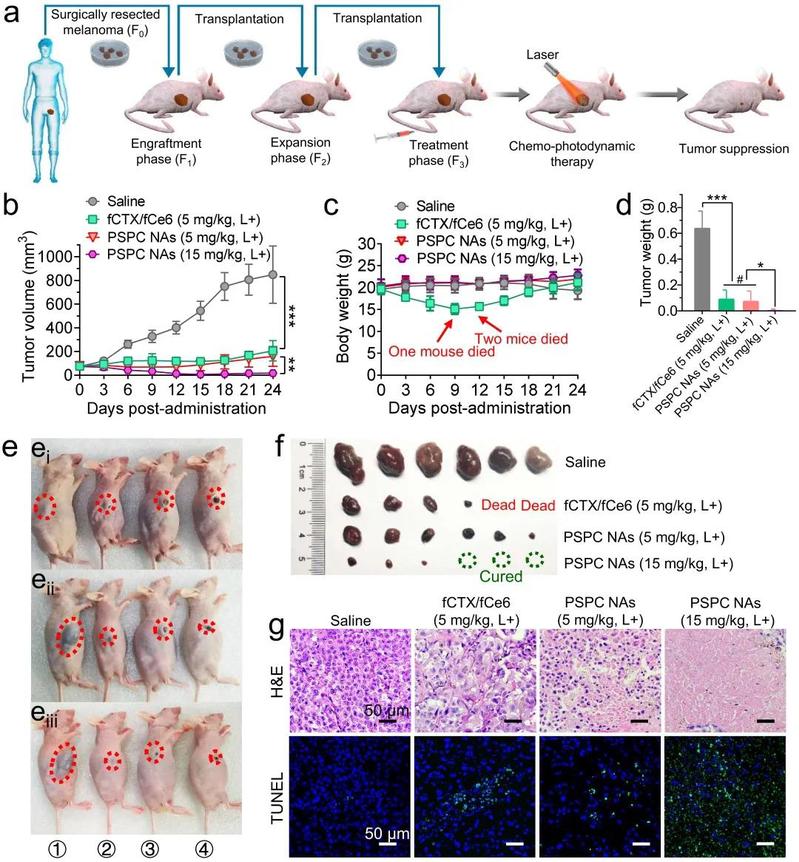
图2. 在临床前肿瘤模型中,先静脉注射PSPC纳米溶液再进行激光治疗,可有效抑制人黑色素瘤来源的移植瘤(PDX)的生长。(a)在Balb/c裸鼠中建立恶性黑色素瘤原位PDX模型的示意图以及治疗方案。(b)每组的肿瘤生长曲线和(c)体重变化。在第0、3和6天静脉注射游离药物和PSPC NAs。(d)治疗观察结束后的肿瘤重量定量图。(e)第6(ei),18(eii)和24(eiii)天的荷瘤鼠照片(①:生理盐水;②:fCTX / fCe6,5 mg/kg +激光;③:PSPC NA,5 mg/kg +激光;④:PSPC NAs,15 mg/kg +激光)。(f)治疗结束后的各组肿瘤照片。(g)肿瘤切片的组织学分析。数据表示为平均值 ± SD(n = 6)。*p<0.05,**p<0.01,***p<0.001,#p> 0.05。
本文第一作者为博士研究生黄领领,第二作者为博士研究生万建钦,通讯作者为王杭祥研究员和高建青教授,该研究得到浙江省自然科学基金杰出青年项目、国家自然科学基金、科技部国家科技重大专项计划、中央高校经费的支持。
来源:浙江大学医学院公众号




